 |
 |
|
|
 |
 |
 |
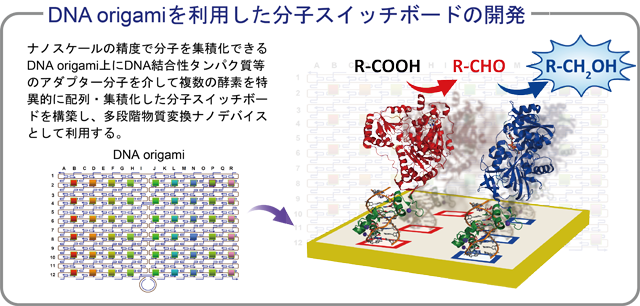
| 生体内においては、タンパク質やRNAなどの機能性分子が相互作用しながら、過渡的な超分子組織体を形成し、物質生産・変換システムを構築している。このようなシステムに倣い、任意の機能性分子を特定の位置にナノスケールの精度で配置することができれば、それぞれの要素を単純に混ぜ合わせただけでは達成することのできないような高効率な物質変換システムを細胞外で構築することができると期待される。我々は、機能性分子を高精度に配置させるための基盤として、DNAで形成されるナノ構造体に注目している。 DNAの高い分子認識能と自己集合能を利用して、一本鎖DNAを設計通りの形に折りたたみ、様々な高次構造体を自在に形成させる方法論(DNA origami法) (ref. 1)を利用し、DNAナノ構造体上にアダプター分子を介して酵素をはじめとする複数の機能性分子を一分子レベルで配置した分子スイッチボードを構築し、複数の生体高分子を特定の配置においたときにどのような機能を発揮するかを明らかにすることを目指している。 |
| DNA origami上への機能性タンパク質配置技術の開発 |
 |
 |
 |
| DNAナノ構造体とタンパク質の複合体による機能化を目指した研究は、これまでにも試みられてきたが、幅広い研究展開を困難としていたのは、複数のタンパク質・酵素を効率的にDNA上に配置するための方法論が希少であったためである。そこで、我々は機能性タンパク質を配置するための新たな技術の開発から着手した。(ref.
2) 我々が注目したのは、zinc finger protein (以下ZFPと示す) に代表されるDNA結合性タンパク質である。ZFPは、アミノ酸配列を変えることで自在にその認識選択性を改変することができるため、複数の機能性タンパク質をDNAナノ構造体へと配置するアダプターとして非常に有用である。実際に2種類の異なるDNA配列選択性を有するZFPを用いて、それぞれのZFPの認識DNA配列をアドレスとして導入したDNA
ナノ構造体に機能性タンパク質を選択的に配置することに成功した。ZFPをアダプターとして用いる利点として、任意のタンパク質発現系を用いて調製したZFP融合タンパク質をそのまま用いることができる点があげられる。実際に、大腸菌を宿主として生産したZFP融合タンパク質を含む大腸菌破砕溶液を、そのままDNA
ナノ構造体と混合するだけで、任意の位置に配置することができることを明らかとした。 |
| ※本成果は、Angew. Chem. Int. Ed. 2012, 51, 2421-2424.に掲載され、本誌Web上でPress Releaseされました。 |
 |
 |
 |
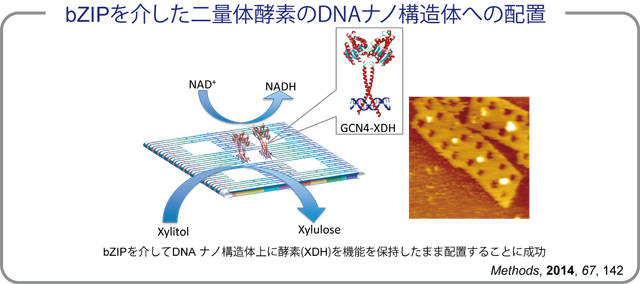
| 前述のZFPは、単量体で存在するタンパク質をDNAナノ構造体上に配置するのに適している。我々は、より幅広い選択肢のタンパク質をDNAナノ構造体上に配置できるように、DNA結合性アダプターの拡張をおこなった。(ref.
3) 異なる性質を持つアダプターとして、basic leucine zipper protein (bZIP)に着目した。bZIPは、ホモまたはヘテロな二量体を形成して、特定のDNA配列と強固に結合する。そのため、二量体を形成して安定に存在し、その活性を発揮している多くの酵素をDNA
ナノ構造体上に配置する場合に、非常に有用であると考えられる。そこで、ホモ二量体を形成するbZIPの一種であるGCN4を、同じく二量体で安定に存在することが知られている酵素(XDH)に導入してその機能を評価した。まず、その融合タンパク質の酵素活性を天然の酵素と比較することで、アダプターを導入したことによる酵素活性への影響を評価したところ、天然の酵素と同等かそれ以上の酵素活性を示すことが明らかとなった。このことは、GCN4を融合したことで、より安定な二量体を形成することが出来るようになったと考えられ、DNA結合性アダプターを用いる大きな利点の一つとして考えられる。また、DNAナノ構造体上への配置割合を評価したところ、GCN4を介して非常に高い割合でかつ酵素活性を損なうことなくDNAナノ構造体に配置できていることが明らかとなった。また、ZFPとbZIPとは、お互いに競合することなく同一のDNAナノ構造体上の異なるアドレスにそれぞれ配置することにも成功した。 |
 |
 |
 |
| さらに我々は、より安定かつ高収率にタンパク質をDNAナノ構造体上のアドレスに配置する目的で、DNAナノ構造体上に共有結合を介してタンパク質を配置できるモジュール型アダプターの開発をおこなった。(ref.4)
我々が注目したのは、特定の基質と反応し、安定な共有結合を形成することが知られているタンパク質タグシステム(例えばSNAP-tag(ref. 5))である。既にタンパク質タグを介して目的タンパク質をDNAナノ構造体上に配置する戦略については報告例があったが、反応速度が遅いことが原因で定量的に固定化することは困難であった。(ref.
6) 我々は、DNA結合性アダプターの迅速かつ高いDNA認識能とタンパク質タグの安定な共有結合形成能を組み合わせることで、共有結合形成過程の反応速度を高めることができ、安定かつ定量的にタンパク質をDNAナノ構造体上に一分子レベルで配置することができると考えた。実際に、DNA結合性アダプターとして我々が採用したZFPの一つであるzif268と、SNAP-tagを融合したzif-SNAPは、SNAP-tagの基質であるベンジルグアニン
(BG)を導入したzif268認識DNAに対して、SNAP-tag単独の場合と比べ、1000倍も高い反応速度で共有結合を形成できることが明らかとなった。さらにDNAナノ構造体上に配置したBG修飾したアドレスに対しても、zif-SNAPを融合した目的タンパク質を迅速かつ定量的に配置することに成功した。これにより、アドレス数をコントロールすることで、配置するタンパク質数を厳密に制御することが可能となった。
特筆すべき点として、DNAナノ構造体上に目的タンパク質を配置し、その機能を評価する場合、バルク溶液中に配置されなかった目的タンパク質が存在すると、それらが原因となり、本来見たい現象の追跡が困難となることが考えられる。本手法により目的タンパク質を共有結合を介して安定に配置できるようになったことで、念入りな洗浄操作で、余剰のタンパク質を容易に除去することが可能となった。また、迅速に配置できることで、長時間の配置処理に伴うタンパク質の失活などが軽減されることも本手法の大きな利点である。 |
 |
| DNAナノ構造体上での高効率な物質変換反応の実現 −分子スイッチボードの構築− |
 |
 |
 |
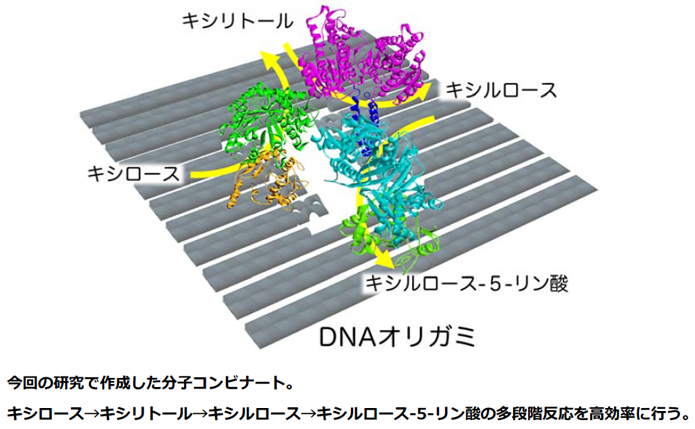
| 前述のこれまでに開発したDNAナノ構造体上に目的タンパク質を配置するDNA結合性アダプター(ref. 2-4) を複数組み合わせることで、DNAナノ構造体上に連続する代謝反応を触媒する2種類の酵素を配置した分子スイッチボードの開発をおこなった。モデルとなる反応として、酵母におけるキシロースからのエタノール生産経路の最初に位置する重要な2段階の酵素反応に着目した。関連する2種類の酵素、キシロースリダクターゼ(XR)とキシリトールデヒドロゲナーゼ(XDH)に、それぞれ遺伝工学的手法を用いてDNA結合性アダプターを融合し、DNAナノ構造体上に配置した。その上で、2段階の代謝反応の効率が、空間配置を変化させることでどのように変化するかを詳細に評価した。また、2種類の分子(基質と補酵素)が酵素間を移動する場合と、1種類の分子(補酵素のみ)が移動する場合における空間配置の影響についても詳細に検討し、新たな知見を得ることに成功した。 |
| 本研究で示したDNAナノ構造体を基盤とした機能性タンパク質のナノ組織体は、様々な生体内システムの試験管内での構築に応用できる。さらに、関与する複数の機能性分子の空間的配置と機能の相関関係を明らかとしながら、精微に設計された多段階物質変換ナノデバイス(分子コンビナート)の開発への展開が期待される。 |
 |
1) P. W. Rothemund, Nature, 2006, 440, 297-302.
2) E. Nakata, F. F. Liew, C. Uwatoko, S. Kiyonaka, Y. Mori, Y. Katsuda, M. Endo, H. Sugiyama, T. Morii, Angew Chem. Int. Ed., 2012, 51, 2421-2424.
3) T. A. Ngo, E. Nakata, M. Saimura, T. Kodaki, T. Morii, Methods, 2014, 67, 142-150.
4) E. Nakata, D. Huyen, T. A. Ngo, M. Saimura, T. Morii, Chem. Commun.,2015, 51, 1016-1019.
5) A. Keppler, S. Gendreizig, T. Gronemeyer, H. Pick, H. Vogel, K. Johnsson, Nat. Biotechnol., 2003, 21, 86-89.
6) B. Saccá, R. Meyer, M. Erkelenz, K. Kiko, A. Arndt, H. Schroeder,
K. S. Rabe, C. M. Niemeyer, Angew. Chem. Int. Ed., 2010, 49, 9378-9383.
7) T. A. Ngo, E. Nakata, M. Saimura, T. Morii, J. Am. Chem. Soc. 2016,
138, 3012-3021.
|
 |
※本紹介文は、論文として発表した内容について記載してあります。この他にも関連する研究をおこなっており、論文として発表次第、随時更新していきます。
|
|
 |
|
|