 |
 |
|
|
 |
| アルツハイマー病患者の病理学的な特徴の一つとして、脳内にPaired helical filament (PHF)と呼ばれる特徴的な繊維状構造体の沈着が観察される。PHFの主成分は過剰なリン酸化修飾を受けたタウタンパク質である。我々はタウタンパク質の繊維形成におけるリン酸化の役割について明らかにすることを目的とし、モデルペプチドを利用してリン酸化が凝集特性および繊維形状に及ぼす影響の評価を行っている
(ref. 1-4)。 |
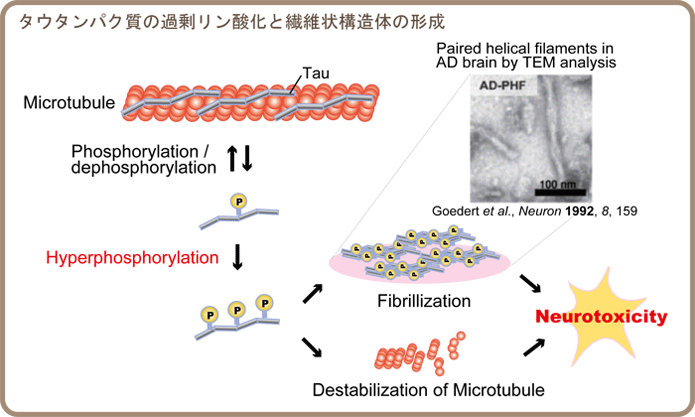 |
| タウタンパク質の配列内において特に凝集性が高く、マイクロ結晶よりその分子構造が明らかなPHF6配列(VQIVYK) をモデルペプチドとし、PHF6配列内においてリン酸化修飾の標的となるチロシンをリン酸化したペプチド(PHF6pY)を化学合成し、チロシンリン酸化が凝集特性に及ぼす効果について検討を行った。また、様々な非天然アミノ酸を導入したPHF6誘導体を化学合成し、電荷の大きさと位置の効果について検討した。(ref.
1)結果、隣接するチロシンリン酸基とリシンεアミノ基の分子内・分子間の静電相互作用によって繊維安定性が大きく変化することを明らかにした。(ref.
2) |
 |
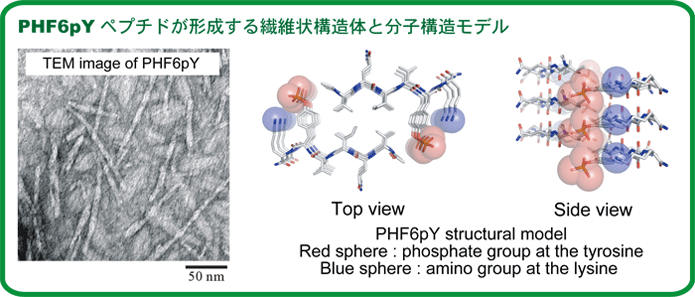 |
| 被リン酸化部位の周辺残基との位置的バランスが、その凝集特性に大きく影響を与えることを新たに見出した。(ref. 3) また興味深いことに、異なる凝集性を持つペプチドが混在した場合、単独のそれとは異なる凝集体形成能を示すことも明らかとした。(ref.
2) 凝集体形成能の新たなる制御方法として注目している。 |
 |
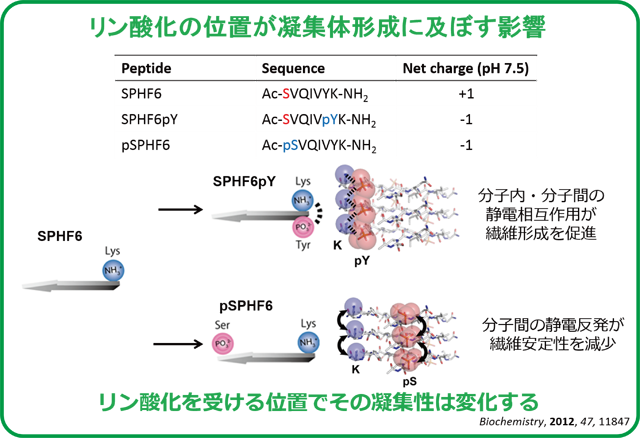 |
また、tauタンパク質にはPFH6のほかに、同様に繊維を形成するペプチドとして、PHF6*が知られている。PHF6*のリン酸化が繊維形成に与える効果について、PHF6と同様にPHF6*のリン酸化体を利用して解析し、pHおよび分子内および分子間の正味電荷と、繊維の形状や形成速度との関連性を明らかにした。(ref.4)
これらの成果は、生体高分子の凝集体形成における構造制御や機能発現において有用な知見となると期待される。 |
1) A. Hirata, K. Sugimoto, T. Konno, T. Morii, Bioorg. Med. Chem. Lett. 2007, 17, 2971-2974.
2) M. Inoue, A. Hirata, K. Tainaka, T. Morii, T. Konno, Biochemistry 2008, 47, 11847-11857.
3) M. Inoue, T. Konno, K. Tainaka, E. Nakata, H. Yoshida, T. Morii, Biochemistry 2012, 51, 1396-1406.
4) M. Inoue, S. Kaida, S. Nakano, C. Annoni, E. Nakata, T. Konno, T. Morii, Bioorg. Med. Chem. 2014, 22, 6471-6480. |
| ※本紹介文は、論文として発表した内容について記載してあります。この他にも関連する研究をおこなっており、論文として発表次第、随時更新していきます。
|
|
|