同じ種類の酵素を密接させると反応活性が上昇する —細胞内での酵素反応を理解するための新しい理論を提唱—
Research Topics / 研究トピックス
2020年7月27日付け、H. Dinh, E. Nakata, K. Mutsuda-Zapater, M. Saimura, M. Kinoshita, T. Morii らの研究「Enhanced enzymatic activity exerted by a packed assembly of single type of enzyme」が王立化学会誌Chemical Scienceに掲載され、2020 Chemical Science HOT Article Collectionに選ばれました。
DOI: 10.1039/D0SC03498C
エネルギー利用過程研究部門 生物機能化学研究分野
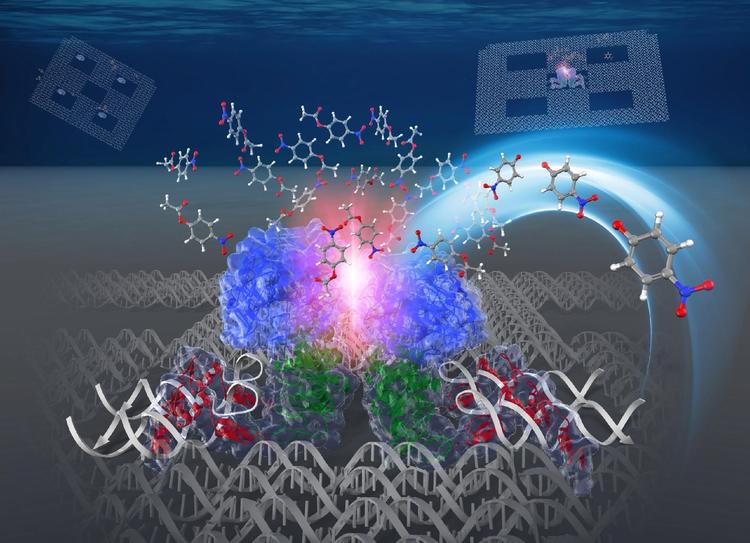
細胞内では、多くの酵素が細胞内小器官などに配置されて、空間的に密集した環境下に存在しています。そのため、細胞内での酵素反応は、生化学実験で用いられる希薄な溶液中での酵素反応とは異なると考えられていますが、これまで試験管の中で、酵素が密集した環境を再現することは困難でした。本研究では、当研究グループで開発した、酵素を1分子ずつ、ナノメートルの精度でDNAナノ構造体の特定の場所に配置する方法によって、単量体として存在する酵素カーボニックアンヒドラーゼを、DNAナノ構造体上に密集した状態と離散した状態で配置し、それぞれの状態で酵素反応を解析しました。同じ酵素濃度で比較したところ、密集した状態にある酵素では、離散した状態にある酵素よりも反応速度が有意に増大するという現象を、初めて見出しました。この現象を解釈するために、酵素表面が密接した場所では、水のエントロピー効果によって、離散した状態にある酵素の表面よりも基質濃度が高くなり、それによって、反応速度が増大するという新しい理論を提唱しました。この理論によって、新しい視点から細胞内での酵素反応の理解が進むと期待されます。
本研究は、附属エネルギー複合機構研究センターの木下正弘 教授との共同研究により実施されました。また、著者の一人である陸田 Zapater 香織 協力研究員は、スペイン・バルセロナ大学からのインターンシップ学生でした。








