 |
 |
|
|
 |
生体内の分子過程を時空間的に計測するプローブの開発は、基礎科学における生命現象の解析のための有力な手段としてのみならず、医療診断や環境分析・食品管理等の多岐にわたる応用利用も期待される技術である。殊に非侵襲的かつ特異的な検出を可能とする蛍光プローブは、生命機能や疾患の解明に重要な情報を得るための有力なツールとして認知されている。
これまでにも数多くの蛍光プローブが報告されているが、その多くは膨大な試行錯誤の上に成り立っており、その論理的な設計戦略はごく一部の報告例に限られていた。
最近我々は、その独自な方法として、自己集合化した蛍光色素誘導体が、酵素反応などの外部刺激をトリガーとして分散することで、OFF/ONのスイッチングが可能なインテリジェントなナノプローブを開発した。 |
 |
 |
 |
| このナノプローブは、ある種の蛍光色素 [例えば、SNARF (seminaphthorhodafluor)] に疎水的な置換基を導入することで、水溶液中で100nm程度の自己集合体を形成したものである(a)。(ref.1)
これまでに様々な蛍光色素誘導体を設計・合成して、その構造と特性の相関関係を評価することで、この蛍光色素誘導体の分散状態と自己集合体状態を、導入する置換基の疎水性を指標とすることであらかじめ予測することが可能となった(b)。 |
 |
 |
 |
| さらにこのナノプローブは、蛍光色素を骨格として有していながらも無蛍光性であり、細胞内や血液中などの生体環境においても安定に存在していることが明らかとなっている。その一方で、酵素に応答して脱離する置換基を導入することで、酵素反応を経て速やかに分散し、蛍光性を回復するユニークな特性を有していた。そこで、このナノプローブの特性に基づいた合理的設計戦略を確立し、(c) ニトロ還元酵素(ref. 2) や(d) エステル加水分解酵素 (ref. 1, 3-4) などの細胞内酵素の活性をリアルタイムに検出することに成功している。もちろん、本設計戦略に基づけば、細胞内酵素以外の検出対象に応答するプローブの設計も可能である。(ref. 5,6) |
 |
 |
 |
| また、自己集合化ナノプローブがどのようにして細胞内に取り込まれていくのかについて、先に示した戦略に基づいて設計した自己集合状態と分散状態を色調変化としてレシオ検出することが可能なレシオ型ナノプローブを用いることで、その経路を明らかとすることにも成功している。(ref.1) |
 |
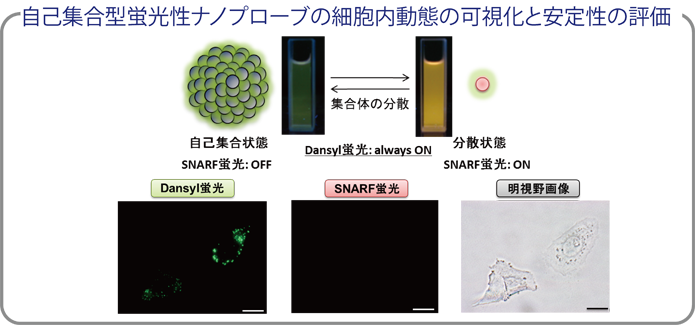 |
 |
| この自己集合化ナノプローブは、他の蛍光色素骨格を用いても実現できることが既に確認されており、現在はこの戦略を拡張するために構造と特性の相関関係についてより精査している。 |
1) E. Nakata, Y. Yukimachi, Y. Nazumi, M. Uwate, H. Maseda, Y. Uto, T. Hashimoto, Y. Okamoto, H. Hori, T. Morii, RSC Adv., 4, 6471 (2014)
2) E. Nakata, Y. Yukimachi, H. Kariyazono, S. Im, C. Abe, Y. Uto, H. Maezawa, T. Hashimoto, Y. Okamoto, and H. Hori, Bioorg. Med. Chem., 17, 6952 (2009)
3) E. Nakata, Y. Yukimachi, Y. Nazumi, Y. Uto, H. Maezawa, T. Hashimoto, Y. Okamoto and H. Hori, Chem. Commun., 46, 734 (2010)
4) E. Nakata, Y. Yukimachi, Y. Nazumi, Y. Uto, T. Hashimoto, Y. Okamoto and H. Hori, Chem. Lett., 39, 734 (2010)
5) E. Nakata, Y. Nazumi, Y. Yukimachi, Y. Uto, H. Hori, T. Morii, Bull. Chem. Soc. Jpn., 88, 327 (2015)
6) E. Nakata, Y. Yukimachi, Y. Uto, H. Hori, T. Morii, Sci. Tech. Adv. Mater.,17, 431 (2016) |
| ※本紹介文は、論文として発表した内容について記載してあります。この他にも関連する研究をおこなっており、論文として発表次第、随時更新していきます。
|
|
|